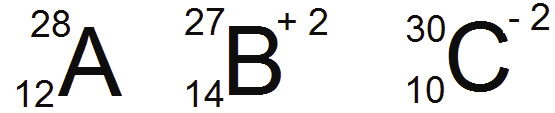Métodos de separação de misturas
Há uma enormidade de métodos diferentes para a separação de misturas, e como são muitos, aqui serão colocados resumidamente, mas estão explicados de forma mais detalhada no livro de química páginas 34 até 39.
A - Métodos para separar misturas sólido-sólido heterogêneas
1- Catação: Separar dois sólidos manualmente. Exemplo: Escolher feijão
2- Levigação: Usar uma corrente de água para separa os sólidos. O mais leve é arrastado pela correnteza, e o mais pesado se mantém no lugar. Exemplo: separar ouro de areia no garimpo.
3- Flotação: Usar um líquido com densidade intermediária entre a dos dois sólidos para separá-los. O mais leve flutuará e o mais pesado afundará, possibilitando a separação. Exemplo: Separar serragem e areia
4- Peneiração: Usar uma peneira para separar sólidos de tamanhos diferentes. Também pode ser usado para separar uma mistura de um sólido com um líquido. Exemplo: escorrer macarrão.
5- Dissolução fracionada: Quando um sólido é solúvel na água e o outro não, pode-se usar o método. Adiciona-se água à mistura, depois se filtra e após a água é evaporada. Exemplo: sal (solúvel) e areia (não-solúvel)
6- Imantação/separação magnética: Usado quando um dos sólidos é atraído por ímãs.
7- Fusão fracionada:Separar sólidos com pontos de fusão diferentes. Exemplo: Reciclagem de metais
8- Ventilação: Para misturas com massas bem diferentes, uma é carregada pelo vento do ventilador, e a outra permanece no lugar.
9- Sublimação fracionada: Funciona da mesma forma que a fusão fracionada, com a diferença de que uma das substâncias tem a propriedade de se sublimar.
10- Cristalização fracionada: Ocorre quando dois sólidos estão em um líquido em que ambos se dissolvem, como sal e açúcar na água. O aquecimento ou resfriamento fará com que um deles cristalize e o outro não, já que possuem propriedades diferentes.
B- Métodos para separar misturas sólido-líquido heterogênenas
11- Filtração: Método parecido com a peneiração, porém o filtro consegue reter partículas bem menores. Exemplo: Passar café.
12- Decantação: Aguardar até que os componentes da mistura se separem pela diferença de densidade, um se acumulando no fundo do recipiente ou boiando. Exemplo: Nas estações de tratamento de água, é usado para remover os resíduos sólidos da água.
13- Centrifugação: É uma decantação forçada, para misturas com densidades muito próximas, que demorariam muito para decantar naturalmente. Exemplo: Exame de sangue.
C- Outros métodos de separação de misturas heterogêneas:
14- Decantação entre líquidos: Com funil de decantação, retira-se o líquido que está em baixo e se deixa o que está em cima, devido à diferença de densidades. Exemplo: Separar água e óleo
15 Separação de gasoso e sólido: Filtração de um gás para extrair as pequenas partículas sólidas. Exemplo: Aspirador de pó.
16- Decantação entre sólido e gasoso: Devido à diferença de densidade, o sólido acaba se depositando abaixo do gasoso. Exemplo: Formação de poeira em cima dos móveis.
D- Métodos de separação de misturas homogêneas
17- Fusão fracionada: Assim como para misturas heterogêneas, funciona para as homogêneas também. Exemplo: separação de ligas metálicas.
18- Evaporação: Deixara a mistura em ambiente aberto até que o líquido evapore, para deixar o sólido no recipiente. Exemplo: Obtenção de sal marinho.
19- Destilação simples: Funciona como a evaporação, mas é feita com um aparelho especial, de modo que o líquido evaporado é condensado, assim ele não é perdido.
20- Destilação fracionada: Como a simples, porém para 2 líquidos ou mais. O líquido com menor ponto de ebulição evapora primeiro, e é recolhido. Exemplo: Separação dos componentes do petróleo.
21- Liquefação fracionada: Para misturar de gases, ao resfriar a mistura lentamente, eles vão um a um se tornando líquidos, e aí podem ser separados pela liquefação fracionada. Exemplo: Separação dos componentes do ar.
Sugestão de exercícios: CA p. 175 até 178, 33 até 43 (gabarito no site)
Modelos atômicos
A primeira ideia de átomo na história surgiu na Grécia, criada por Demócrito e outros filósofos gregos, e tinha a concepção filosófica do átomo como sendo uma bolinha maciça e indivisível.
Dois mil anos depois, John Dalton elaborou o primeiro modelo atômico embasado em experiências. Assim como os filósofos, ele acreditava que o átome é indivisível, o que hoje sabemos que é incorreto, mas ele propôs muitas teses que são verdadeiras até hoje. Também propôs uma maneira de representar os átomos que facilita a compreensão do que são substâncias simples, compostas e misturas.
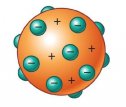
J. J. Thomson, em 1897, descobriu os elétrons, mostrando assim, que o átomo era divisível. Segundo seu modelo, o átomo seria como um pudim de passas, uma bolinha maciça com pontinhos incrustados.
Rutherford, por meio de seu experimento com uma lâmina de ouro, descobriu que o átomo não era uma esfera maciça, e que possui mais espaços vazios do que preenchidos.
Bohr aperfeiçoou o modelo atômico de Rutherford, porém sem desmentir nada do que ele havia proposto. Em seu modelo, o átomo possui um núcleo pequeno e com cargas positivas, e é circundado pelos elétrons, que possuem órbitas circulares. Ele descobriu que haviam sete camadas diferentes :K, L, M, N, O, P e Q (hoje sabe-se que há oito), e que cada camada tem um número fixo de máximo de elétrons que pode conter.
Sommerfeld complementou o estudo de Bohr, mostrando que os níveis de enegia podiam ainda ser divididos em subníveis, chamados s, p, d, f.
De Broglie propôs que os átomos se comportam ora como partícula e ora como onda, no chamado princípio da dualidade.
Heisenberg demonstrou que é impossível determinar, no mesmo instante a velocidade e a posição do elétron, o chamado princípio de incerteza.
Schrödinger dividiu cada subnível s, p, d, f em om orbitais, qu eseriam a região mais provável de se encontrar um elétron. Cada orbital contém 2 elétrons com spins (rotações) contrários.
Linus Pauling criou a forma mais aceita de explicar a distribuição dos elétrons na eletrosfera conforme sua energia. Eis o seu diagrama:
Experimentos que levaram à formulação dos modelos atômicos
A teoria de Dalton foi baseada principalmente nas Leis Ponderais (livro p. 51), e em alguns experimentos rudimentares, pois na época ele não possuía equipamentos modernos para provar suas teses.
A teoria de Thomson foi baseada em um experimento que utilizava uma ampola de Crookes (tubos de vidro fechados com um eletrodo positivo e outro negativo) contendo gases a pressões extremamente baixas fez uma descoberta imprescindível para a evolução do modelo atômico.
Ele submeteu estes gases a voltagens elevadíssimas, desse modo foi possível observar o aparecimento de emissões, os raios catódicos. Em seguida, foi colocado um campo elétrico externo e, por fim, verificou-se que o feixe de raios catódicos era desviado, sempre indo na direção e sentido da placa carregada positivamente. Portanto, estas emissões possuíam cargas negativas.
Outro ponto importante é que não importava o gás utilizado, sempre ocorria o mesmo; assim Thomson chegou à conclusão lógica de que estas cargas negativas estavam presentes em toda e qualquer matéria, eram parte integrante destas. Desse modo, provou-se que, ao contrário do que Dalton havia afirmado, o átomo não era indivisível, pois possuía uma partícula subatômica negativa, que ficou denominada elétron.
O experimento de Rutherford teve como conclusão o fato de que o átomo tem muito mais espaços vazios do que matéria propriamente dita.
Para provar que os átomos não são maciços, Rutherford bombardeou com partículas alfa (provenientes de uma amostra do polônio, que é radioativo) uma fina placa de ouro. Ele notou que a maior parte dessas partículas atravessava a lâmina, e pouquíssimas eram repelidas ou desviadas. O motivo de algumas partículas serem repelidas é porque bateram de frente com o núcleo atômico do ouro. As que sofreram desvio passaram muito perto do núcleo, pois a partícula alfa é de carga positiva, e o núcleo do ouro também.
Assim, a Experiência de Rutherford provou que o átomo possui um grande vazio, um espaço muito grande entre os elétrons e o núcleo.

Bohr foi o cientista que descobriu a existência das camadas de energia (K, L, M, N, O, P, Q) onde os elétrons se distribuem. Para fazer essa descoberta, ele primeiramente concluiu que um gás emitia luz quando uma corrente elétrica passava nele. Portanto, os elétrons absorvem energia elétrica e depois a liberam na forma de luz. Com isso, ele deduziu que um átomo tem um conjunto de energia disponível para seus elétrons. Esse conjunto de energias quantizadas mais tarde foi chamado de níveis de energia. Mas se um átomo absorve energia de uma descarga elétrica, alguns de seus elétrons ganham energia e passam para um nível de energia maior, nesse caso o átomo está em estado excitado.
A experiência de Bohr foi o "teste da chama", em que ele verificou o espectro luminoso de cada átomo quando aquecido. Conforme a coloração da chama, pode-se comprovar que cada salto de camada ocorre com uma determinada energia
Sugestão de exercícios: Livro p. 61 e 62 ex. 1 a 10 (gabarito no final do livro)
Átomos neutros e íons
Os átomos são neutros, pois têm número de caragas positivas (prótons) e cargas negativas (elétrons) igual, então estão em equilíbrio. Porém, os átomos têm a capacidade de ganhar ou perder elétrons, ficando com diferença entre prótons e elétrons.Se houver perda de elétrons, o átomo virtará um íon positivo, chamado cátion, e sua carga será +. Se ele ganhar elétrons, se tornará um íon negativo, chamado ânion, com carga -.
ATENÇÃO:
Um íon com carga - possui MAIS partículas negativas, portanto GANHOU elétrons.
Um íon com carga + possui MENOS partículas negativas, portanto PERDEU elétrons.
Igualdades químicas
Isótopos: Possuem o mesmo número de prótons (Z)
Isótonos: Possuem o mesmo número de neutrons (N)
Isóbaros: Possuem o mesmo número de massa (A)
Isoeletrônicos: Possuem o mesmo número de elétrons (E)
Exemplo:
 |
| ISÓBAROS |
 |
| ISÓTONOS |
 |
| ISÓTOPOS |
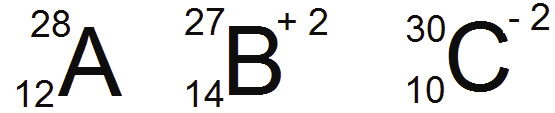 |
ISOELETRÔNICOS
|
Sugestão de exercícios: Livro p. 71 e 72 (gabarito no final do livro)
Distribuição eletrônica de átomos neutros e íons
A distribuição dos elétrons em camadas na eletrosfera ocorre utilizando o diagrama de Linus Pauling.

Podemos perceber que nesse diagrama, os elétrons ocupam camadas mais distantes sem antes terem ocupado completamente as mais internas.. Um dos motivos disso é a repulsão que ocorre entre cargas iguais, afastando os elétrons.
Para fazer a distribuição, a regra é a seguinte: Primeiro deve-se verificar quantos elétrons o átomo possui. Sempre se começa pelo menor nível de energia (1s²). Nunca se deve ultrapassar o máximo de elétrons permitido em cada subnível. Quando um subnível estiver totalmente preenchido, passar para o próximo.
Três conceitos são muito importantes. Camada de Valência é a última camada utilizada na distribuição, e é uma das letra K, L, M, N... Subnível mais energético é o último subnível utilizado, por exemplo, 6s², ou 4s². O elétron mais energético/diferenciação é o último elétron distribuído. ATENÇÃO: Nem sempre a camada de valência corresponde ao subnível mais energético (ver exemplo do livro p. 76 e exemplo do CA p.216)
Os íons possuem uma distribuição eletrônica um pouco diferente. Para realizar essa distribuição deve-se primeiro fazer a distribuição dos elétrons no estado fundamental (neutro), e depois retirar/colocar os elétrons que foram modificados na forma iônica.
ATENÇÃO: Os elétrons devem ser adicionados/retirados da última camada (camada de valência), que não necessariamente é a [ultima da distribuição (subnível mais energético). Ver os exemplos das págs. 77 e 78 do livro.
Sugestão de exercícios: Livro p. 83 ex. 1 e 2.
Números quânticos
Os números quânticos indicam a região de máxima probabilidade de se encontrar um elétron. Cada número indica um dado que ajuda a encontrá-lo.
Número quântico principal (n): É o número que indica em qual camada /nível de energia o elétron se encontra. Como existem 8 camadas (K, L, M, N, O, P, Q, R), o número quântico N varia de 1 a 8.
Número quântico secundário/azimutal (l): Indica o subnível em que o elétron se encontra (s, p, d ou f). Para o subnível s, é atribuído o valor 0, e nos outros subníveis os valores são 1 até 3.
Número quântico magnético (m): Indica o orbital do elétron (orbital é uma divisão do subnível),
Deve-se distribuir os elétrons, da esquerda para a direita, um por quadrado até o fim e depois recomeçar (máximo 2 elétrons por quadrado). O orbital em que for colocado o último elétron é o número m ( cada quadrado tem um número, conforme a tabela.
Número quântico spin (s): Se refere ao sentido de rotação do elétron, portanto pode ser positivo ou negativo. O valos é 1/2, portanto é -1/2 ou +1/2. Existe a convenção de que o 1 elétron do orbital tem seta para cima e valor de spin negativo, e o segundo do orbital será positivo.
Ver exemplo do livro p. 81.
Sugestão de exercícios:Livro p. 83 e 84 ex. 3 até 10 (gabarito no fim do livro).
A tabela periódica organiza os elementos químicos em ordem crescente de número atômico. A Tabela Periódica é organizada da seguinte forma:
Colunas Verticais: são as chamadas famílias (divididas em A e B, sendo oito de cada) ou grupos (numerados de 1 a 18);
Família 1A (Grupo 1): Metais Alcalinos
Família 2A (Grupo 2): Metais Alcalino-Terrosos
Família B (Grupo 3 à 12): Metais de Transição
Família 3A (Grupo 13): Família do Boro
Família 4A (Grupo 14): Família do Carbono
Família 5A (Grupo 15): Família do Nitrogênio
Família 6A (Grupo 16): Calcogênios
Família 7A (Grupo 17): Halogênios
Família 0 ou 8A (Grupo 18): Gases Nobres
Colunas Horizontais: são os chamados períodos. Ao todo na tabela, eles são sete.
A partir do período, nós conseguimos determinar o número de níveis de um átomo de qualquer elemento. O subnível mais energético e o número de elétrons podem ser identificados facilmente pela família.
Se o subnível for s ou p, o número do subnível será o do período. Se for d, o número deve ser somado a 1, e se for f, +2.
Bons estudos!