Critérios:
Frente 1:
- Problemas envolvendo conjuntos
- Conjuntos numéricos
- Sistema cartesiano ortogonal
Produto cartesiano e relação- Função
Gráfico de função
Frente 2:
- Arcos notáveis e arcos complementares
- Razões
trigonométricas em um triângulo qualquer
- Circunferência:
arco, ângulo central e comprimento
Arcos
simétricosSeno
e cosseno de um ângulo no ciclo trigonométrico
Problemas envolvendo conjuntos:
Para este critério, não há muitas explicações, deve-se fazer exercícios para praticar. Para resolver os problemas, deve-se sempre reunir os dados e em seguida preencher o diagrama começando pelas intersecções e subtraindo-as depois quando for preencher as partes de fora.
Sugestão de exercícios: livro p. 67 a 69 ex. 1 a 14 (gabarito no fim do livro)
Conjuntos numéricos:
Conjunto dos Números Naturais
São todos os números inteiros positivos, incluindo o zero. É representado pela letra maiúscula N.
Caso queira representar o conjunto dos números naturais não-nulos (excluindo o zero), deve-se colocar um * ao lado do N:

N = {0,1,2,3,4,5,6,7,8,9,10, ...}
N* = {1,2,3,4,5,6,7,8,9,10,11, ...}
Conjunto dos Números Inteiros
São todos os números que pertencem ao conjunto dos Naturais mais os seus respectivos opostos (negativos).
São representados pela letra Z:
Z = {... -4, -3, -2, -1, 0, 1, 2, 3, 4, ...}
O conjunto dos inteiros possui alguns subconjuntos, eles são:
- Inteiros não negativos
São todos os números inteiros que não são negativos. Logo percebemos que este conjunto é igual ao conjunto dos números naturais.
É representado por Z+:
Z+ = {0,1,2,3,4,5,6, ...}
- Inteiros não positivos
São todos os números inteiros que não são positivos. É representado por Z-:
Z- = {..., -5, -4, -3, -2, -1, 0}
- Inteiros não negativos e não-nulos
É o conjunto Z+ excluindo o zero. Representa-se esse subconjunto por Z*+:
Z*+ = {1, 2, 3, 4, 5, 6, 7, ...}
Z*+ = N*
- Inteiros não positivos e não nulos
São todos os números do conjunto Z- excluindo o zero. Representa-se por Z*-.
Z*- = {... -4, -3, -2, -1}
Conjunto dos Números Racionais
Os números racionais é um conjunto que engloba os números inteiros (Z), números decimais finitos (por exemplo, 743,8432) e os números decimais infinitos periódicos (que repete uma sequência de algarismos da parte decimal infinitamente), como "12,050505...", são também conhecidas como dízimas periódicas.
Os racionais são representados pela letra Q.
Conjunto dos Números Irracionais
É formado pelos números decimais infinitos não-periódicos. Um bom exemplo de número irracional é o número PI.
Também são irracionais todas as raízes não exatas, como a raiz quadrada de 2 (1,4142135 ...)
Conjunto dos Números Reais
É formado por todos os conjuntos citados anteriormente (união do conjunto dos racionais com os irracionais).
Não fazem parte desse conjunto apenas os números que não existem, como raiz par de número negativo ou fração de denominador 0.
Representado pela letra R.
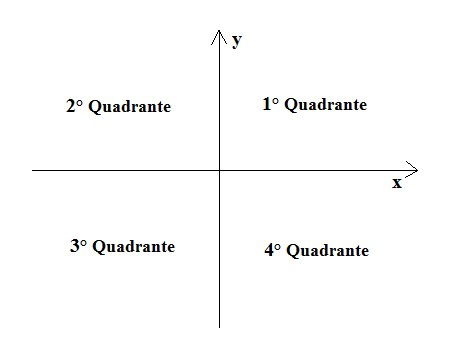
Sistema Cartesiano Ortogonal
Se duas retas se cruzam e formam um ângulo de 90º elas são perpendiculares. A perpendicularidade dessas duas retas forma um sistema cartesiano ortogonal.
As duas retas são chamadas de eixos:
Eixo das abscissas: reta x (horizontal)
Eixo das coordenadas: reta y (vertical)
Onde as retas x e y se encontram é formado um ponto, que é chamado de ponto de origem (0,0)
O sistema cartesiano ortogonal é dividido em quatro partes e cada uma é um quadrante.
Um ponto no sistema cartesiano ortogonal é formado por dois pontos, um do eixo das abscissas e outro do eixo das ordenadas.
O ponto no sistema cartesiano ortogonal é chamado de par ordenado, como se fosse um jogo de batalha naval
O ponto P possui um número a que é a abscissa do ponto P.
O ponto P possui um número b que é a ordenada do ponto P.
(a, b) é chamado de par ordenado do ponto P (sempre primeiro a abcissa e depois a ordenada)
Portanto, para determinarmos um ponto P no sistema cartesiano ortogonal é preciso que as abscissas e as ordenadas sejam dadas.
Função
Na Matemática, o conceito de função é inteiramente ligado às questões de dependência entre duas grandezas variáveis.
A função f(x) = a + b . x possui um coeficiente fixo (a) e um variável b, que é o n de x. o f(x) variará em função disso.
Exemplo: Ana é vendedora. Seu salário é de R$ 800 fixos + 5% do valor que ela vender. Podemos representar isso como uma função:
f(x) = 800 + 0,05. (x)
Se Ana vender em um mês um total de R$ 5000, qual será seu salário?
f (x) = 800 + 0,05 . 5000
f (x) = 800 = 250
f (x) = 1150
Arco notável e arcos complementares:
Os arcos notáveis são ângulos cujos senos, cossenos e tangentes são valores importantes na matemática. Eis aqui a famosa tabela.
Nos arcos, podemos notar que é interessante a relação quando eles são complementares (somam 90º). Quando isso acontece, o seno de um é o cosseno de outro, e vice-versa. Além disso, a tangente de um é o inverso da tangente do outro (é só inverter a fração). Isso é facilmente observável em 30º e 60º, que têm seno e cosseno opostos e tangentes invertidas (√3 / 3 é na verdade 1/ √3 , mas racionalizado)
mas se aplica a todos os complementares.
Razões Trigonométricas em um Triângulo Qualquer
Em triângulos quaisquer (não precisam ser retângulos), o seno de um ângulo vai ser igual ao de seu suplementar (soma 180º), e o cosseno é oposto do suplementar.
Exemplo:
45º e 135º são suplemtentares.
Sen 45° = √2 /2 e cos 45° = √2 /2
então
Sen 135° = √2 /2 e cos 135° = -√2/ 2
Lei dos senos: A razão dos senos dos ângulos do triângulo com seus lados opostos será sempre igual, e também é equivalente a 2 raios caso o triângulo esteja inscrito em uma circunferência.
Na imagem faltou a relação de = 2r, não esquecer dela!
Exemplo:
Nesse triângulo, montamos a regra de três assim:
90 / sen 45° = x / sen 120°
90 / √2/2 = x / 1/2
90 . 1/2 = x . √2/2
45 = x . √2/2
90 = √2x
90 / √2 = x
45√2 = x
Notem que as duas divisões por 2 já poderiam ter sido cortadas antes!
A lei dos cossenos é mais complexa.
Sua fórmula é:
a² = b² + c² + 2.b.c. cos  (para descobrir b ou c, é só inverter as letras)
Exemplo:
x² = 6² + 10² + 2.6.10. cos 120°
x² = 36 + 100 + 2.60. 1/2
x² = 136 + 120. 1/2
x² = 136 + 60
x² = 196
x = √196
x = 14
Circunferência: arco, ângulo central e comprimento
O comprimento de uma circunferência é dado em valor de seu raio, conforme a fórmula C = 2 𝛑 r
Exemplo: Uma praça circular tem raio de 40 m. Quantas metros anda uma pessoa quando dá 3 voltas na praça?
C = 2 𝛑 r
C = 2. 𝛑 . 40
C = 80𝛑
80𝛑 é o comprimento da circunferência da praça. Ao dar 3 voltas na praça, será 240𝛑. Usando 𝛑= 3,14 teremos que o comprimento é 753,6 metros, mas a maioria dos exercícios não pede a troca do 𝛑 por 3,14.
O arco de um círculo é uma parte de sua circunferência.
Ângulo central é o ângulo da abertura do arco.
Para calcular a medida do arco e a do ângulo central, usamos a regra de três. Sabemos que em uma circunferência completa, o ângulo é 360° e a medida da circunferência é 2𝛑 radianos , e 180° tem 𝛑 radianos. Com essas relações podemos resolver os problemas.
Exemplo: um arco tem abertura de 100°. Quantos radianos tem o comprimento desse arco?
Sugiro fazer muitos exercícios, do livro e do CA. Bons estudos!